Обезболивающее действие тока монополярной емкостно-резистивной радиочастоты у пациентов с миофасциальным болевым синдромом шеи: пилотное рандомизированное контролируемое исследование
Авторы: Изабель Мария Альгуасиль-Диего, Хосуе Фернандес-Карнеро, София Лагуарта-Вал, Роберто Кано-де-ла-Куэрда, Сезар Кальво-Лоб,о Роза Мартинес-Пьедрола, Лаура Кристина Луна-Олива, Франсиско Молина-Руэда.
DOI: http://dx.doi.org/10.1590/1806-9282.65.2.156
ОБЩИЕ СВЕДЕНИЯ
ИСТОРИЯ ВОПРОСА: Вопрос использования токов емкостно-резистивной монополярной радиочастоты (РЧ) для лечения боли в шее на сегодняшний день характеризуется полным отсутствием изученности. Цель настоящего исследования состояла в изучении непосредственного эффекта от воздействия электрического тока емкостной резистивной монополярной радиочастоты (РЧ = 448 кГц) в сравнении с эффектом плацебо на (1) уменьшение интенсивности боли в шее в миофасциальных триггерных зонах (MTrP), (2) снижение индекса инвалидности шеи и (3) увеличение амплитуды движения шейного отдела позвоночника (CROM).
МЕТОДЫ: Было проведено рандомизированное двойное слепое плацебо-контролируемое исследование (NCT02353195). Пациенты с миофасциальным болевым синдромом в шейной области (N=24) с активной миофасциальной триггерной зоной в одной верхней трапециевидной мышце были случайным образом поделены на две группы: «радиочастотная» группа, которая прошла восемь сеансов воздействия током монополярной емкостно-резистивной радиочастоты на верхнюю трапециевидную мышцу и группа плацебо (ГП), которая прошла восемь сеансов воздействия током плацебо-радиочастоты на ту же мышцу. Оценке после первого сеанса и после серии из восьми сеансов подвергалась визуальная аналоговая шкала (ВАШ), амплитуда движения шейного отдела позвоночника (CROM) и индекс инвалидности шеи (NDI).
РЕЗУЛЬТАТЫ: Оценка ВАШ по критерию Уилкоксона показала статистически значимые различия между исходным состоянием, состоянием сразу после первого сеанса и состоянием после восьми сеансов (p<0,001). У участников исследования из ГП значимых различий обнаружено не было. Различий между группами не наблюдалось. Показатели NDI улучшились в обеих группах после восьми сеансов, но различий между группами обнаружено не было (p<0,05). Дисперсионный анализ (ANOVA) по фактору времени показал статистически значимые изменения в правом вращении шейного отдела позвоночника в обеих группах (F = 4,112; p = 0,026) после восьми сеансов.
ВЫВОДЫ: Несмотря на отсутствие различий между двумя группами, воздействие током монополярной емкостно-резистивной РЧ могло потенциально повлиять на интенсивность боли.
КЛЮЧЕВЫЕ СЛОВА: Миофасциальные болевые синдромы. Боль в шее. Амплитуда движения, суставная. Радиочастотная абляция/методы.
ПЕРЕЧЕНЬ ПРИНЯТЫХ СОКРАЩЕНИЙ
• Амплитуда движения шейного отдела позвоночника (CROM)
• Миофасциальный болевой синдром (МФБС)
• Миофасциальные триггерные зоны (MTrP)
• Монополярная емкостно-резистивная радиочастота (MCRRF)
• Индекс инвалидности шеи (NDI)
• Интенсивность боли в шее (NPI)
• Группа плацебо (ГП)
• Радиочастота (РЧ)
• Радиочастотная группа (РЧГ)
• Визуальная аналоговая шкала (ВАШ)
ВВОДНАЯ ЧАСТЬ
Боль в шее на сегодняшний день входит в число основных проблем здоровья населения развитых стран1 и является одной из основных причин инвалидности в мире. Боль в шейной области может привести к развитию негативных стратегий преодоления (к игнорированию проблемы) и в результате вызвать инвалидность и снижение качества жизни, что, в свою очередь, может перерасти в фазу депрессии и тревожных неврозов.
Данная проблема затрагивает примерно 50% людей на том или ином этапе их жизни, а ее социальные и экономические последствия весьма серьезны.
Болевой синдром в шейной области имеет тенденцию к хроническому течению, при этом его этиология редко известна, что заставляет относить его обычно к неспецифическим или механическим болям в шее6. В отличие от этой нозологической формы частой причиной развития боли в шее считается миофасциальный болевой синдром (МФБС). При осмотре МФБС характеризуется наличием миофасциальных триггерных точек (MTrP) в скелетных мышцах, состоящих из зон с повышенной раздражительностью, которые расположены в пальпируемых, натянутых связках мышечных волокон.
Эффективность и безопасность комбинированной терапии, включающей в себя как традиционные, так и дополнительные альтернативные методы лечения, до сих пор полностью не установлены. Существуют различные процедуры терапии миофасциального болевого синдрома шеи, в число которых входит электротерапия, программы просвещения пациентов,инъекционная терапия, иглоукалывание и иглорефлексотерапия.
Пациенты с болью в шее, как правило, одновременно проходят традиционную терапию наряду с дополнительными альтернативными методами лечения в надежде на достижение более ощутимого эффекта с лучшими показателями безопасности. К таким альтернативным терапевтическим процедурам относят воздействие током радиочастоты (РЧ). РЧ энергия на сегодняшний день является наиболее часто используемым источником для создания термического эффекта терапевтического уровня. Температурное воздействие в сверхфизиологических дозах всегда использовалось в медицине для вызова структурных и биологических ответов в тканях. Несмотря на то, что наиболее распространенным применением токов РЧ является применение их в качестве инструмента гальванокаустики, с равным успехом их можно использовать и в неабразивной форме, контролируя нагрев целевых тканей для получения структурных и биологических терапевтических эффектов.
Именно в этом и состоит основной принцип действия неинвазивной монополярной емкостно-резистивной радиочастотной терапии (448 кГц) (MCRRF). В целом ряде научных исследований подробно описано, что действие РЧ на мышцы обусловлено воздействием на миогенные клетки-предшественники. Кроме того, РЧ стимулирует воспалительный и антиноцицептивный ответ, который обусловлен созданием обратного температурного градиента и емкостной связи для передачи энергии в объеме ткани. В качестве средства для восстановления тканей недавно было предложено использовать молекулярные и клеточные механизмы, отличные от термических, работающие посредством местного стимулирования размножения мезенхимальных клеток.
В рамках пилотного исследования есть возможность оценить применимость процедур подбора субъектов, рандомизации, удержания и оценки, а также новых методов и внедрения инновационной процедуры.
Данное пилотное исследование было направлено на оценку применимости MCRRF для лечения миофасциального болевого синдрома шеи сразу после одного сеанса и после восьми сеансов терапии. По нашим данным это первое исследование эффективности MCRRF в лечении миофасциального болевого синдрома шеи.
МЕТОДЫ
Участники
Участники были набраны в реабилитационной зоне университета короля Хуана Карлоса в период с октября 2013 года по июнь 2014 года. К критериям для включения в группу исследования относился возраст от 18 до 60 лет и наличие миофасциального болевого синдрома шеи. Локализация боли в шее определялась как шейная область, возможно, с рефлекторной или иррадиирующей болью в затылок, затылочные мышцы, плечи и верхние конечности. Симптомы должны были наблюдаться в течение, как минимум, шести месяцев. Должна была иметься хотя бы одна активная миофасциальная триггерная зона в одной верхней трапециевидной мышце. При двусторонней боли в шейной области для терапии назначалась наиболее болезненная сторона. Все процедуры в рамках данного исследования были спланированы в соответствии с этическими принципами Хельсинкской декларации, одобрены комитетом по этике университета короля Хуана Карлоса (15/2013) и зарегистрированы на сайте ClinicalTrials.gov (NCT02353195).
К критериям исключения из группы исследования относились тяжелые поражения шейного отдела позвоночника, такие как спинальный стеноз, пролапс диска, послеоперационные состояния шейно-плечевой области, тяжелая травма в анамнезе, хлыстовая травма, спастическая кривошея, нестабильность, мигрень, REV ASSOC MED BRAS 2019; ущемление периферических нервов, фибромиалгия, поражения плечевого пояса, воспалительные ревматические заболевания, тяжелые психические заболевания и беременность.
Первоначально были отобрано 26 пациентов с хронической неспецифической болью в шее.
Критерии диагностики активной миофасциальной триггерной зоны (MTrP)
Активная MTrP выбиралась в одной верхней трапециевидной мышце в соответствии с критериями Симонса и др. Необходимым условием диагностики активного MTrP являлось наличие узелка в натянутых связках скелетных мышц, распознавание пациентом боли при стимуляции и ограничение амплитуды движений при полном растяжении. В том случае, если в верхней трапециевидной мышце было более 1 активной MTrP, для терапии выбиралась наиболее гипералгезическая миофасциальная триггерная зона (вызывающая боль большей интенсивности при одинаковом давлении стимуляции). Кроме того, экспертами были продемонстрированы опыт и специализация, необходимые для достижения оптимального взаимного согласия (коэффициент каппа; k = 0,63) при диагностике активного MTrP в верхней трапециевидной мышце.
План исследования
Данное пилотное исследование было проспективным, рандомизированным, двойным слепым и плацебо-контролируемым, направленным на определение применимости монополярной емкостно-резистивной радиочастотной терапии (448 кГц) к пациентам с миофасциальным болевым синдромом шеи. Данная статья составлена в соответствии с указаниями Единых стандартов представления результатов испытаний (CONSORT). Результаты проведенного пилотного исследования могут использоваться в качестве руководства при разработке и проведении более масштабного исследования эффективности терапии. Те компоненты, которые сочли неприменимыми или неудовлетворительными, в последующем исследовании будут подвергнуты изменениям или будут полностью исключаться, а именно, побочные эффекты, число выбывших из исследования, электрическая доза и изменение итоговых показателей.
Каждый субъект, отобранный для исследования, был случайным образом назначен либо в группу плацебо (ГП), либо в радиочастотную группу (РЧГ), с помощью сгенерированных компьютером через ПО Graph Pad (Graphpad Software, Inc., La Jolla, CA 92037 USA) случайных порядковых номеров. Для проведения исследования была заранее подготовлена таблица, где все назначения (распределения) в группы были скрыты. Используемый процесс рандомизации был заблокирован. Терапия проходила для участников в слепом режиме. Распределение по группам было скрыто, пациенты получали назначенную процедуру в непрозрачных конвертах, терапевт, проводивший процедуру, не знал результатов оценки до конца сбора всех данных, а показатели выбывших из исследования регистрировались после рандомизации.
Была составлена анкета для сбора исходных демографических данных и данных о возрасте участников.
Пациентам была выдана карта со схематическим изображением тела, чтобы они могли отметить локализацию их боли, и анкета с вопросами, характеризующими испытываемую ими боль.
Оценку интенсивности боли и амплитуды движений шейного отдела позвоночника (CROM) проводили до начала терапии, а также после первого и восьмого сеансов. Индекс инвалидности шеи оценивался до начала терапии и сразу после восьми сеансов, а выставление оценки всегда выполнялось в одно и то же время дня. Исследование было пилотным.
Процедура
Для MCRRF использовался аппарат INDIBA® (448 кГц). К больной области прикладывался подвижный емкостной (CAP) электрод диаметром 35 мм и резиз- стивный (RES) электрод диаметром 30 мм, а в качестве возвратного к брюшной полости прикладывался плоский электрод. Сама процедура проходила следу- ющим образом: на зону, испытывающую боль наибольшей интенсивности, и прилегающую к ней область (вблизи от наиболее гипералгезической миофасциальной триггерной точки на верхней трапециевидной мышце) наносился крем, доза электрического воздействия увеличивалась за счет перемещения подвижного электрода, не выходя за уровень переносимости пациента, при этом контроли- ровалась переносимая пациентом температура кожи. ГП проходила процедуру тем же аппаратом, но в нефункциональном режиме (без источника энергии). Участники были проинформированы, что аппарат не генерирует тепло. Терапия продолжалась 12 минут два раза в неделю в течение четырех недель (всего восемь сеансов). Тера- певтическую эффективность оценивали по критериям облегчения симптомов до лечения в сравнении с симптомами после лечения, а также сравнением показателей между группами участников. Во время курса лечения не проводилось никаких других видов терапии, которые могли бы повлиять на оценку терапевтической эффективности. Во время исследова- ния участники не принимали никаких лекарств. Лече- ние проводил опытный терапевт. Оценщик, не осведомленный о распределении участ- ников по группам, записывал ответы участников по визуальной аналоговой шкале (ВАШ) боли, а также измерял амплитуду движений шейного отдела позво- ночника (CROM) и индекс инвалидности шеи (NDI) до и после курса лечения.
Итоговые показатели
Интенсивность боли измеряли с помощью 100-мм ВАШ. Шкала состоит из 100-миллиметровой горизонтальной линии со словами, описывающими интенсивность боли, в диапазоне от «боли нет» (крайнее левое положение) до «сильнейшая мыслимая боль» (крайнее правое положение). Воспринимаемый пациентами уровень боли измеряли в покое, нанося на ВАШ соответствующую перпендикулярную метку. Описанный метод является действенным методом измерения уровня боли, а о психометрических свойствах ВАШ широко известно. Минимальное клинически значимое различие по ВАШ определяется с учетом обнаружения разницы в 8,6 мм (на основе предыдущего исследования с показателем <40 мм с началом боли более 12 недель) сразу после лечения. По итогам предыдущих исследований было отмечена хорошая надежность и достоверность ВАШ. Кроме того, для оценки использовался опросник определения индекса инвалидности шеи (NDI), заполняемый пациентами самостоятельно, посредством которого определялась степень влияния боли в шее на ограничение жизнедеятельности пациента. Опро- сник состоит из десяти вопросов в следующих областях: Интенсивность боли, уход за собой, поднятие тяжестей, чтение, головные боли, концентрация, работа, вождение, сон и отдых. Каждый вопрос содержит шесть вариантов ответа, оцениваемых от 0 (нет инвалидности) до 5 (полная инвалидность). Баллы по всем разделам затем суммируются. Подсчет итогового результата выполняется по шкале от 0 до 50 (где 0 — наилучший результат, а 50 — наихудший). NDI характеризуется хорошей конструктной валидностью. NDI считается надежным инструментом для измерения боли в шее и инвалидности у пациентов с болью в шее, вызванной острыми или хроническими состояниями, а также у пациентов, страдающих скелетно-мышечными нарушениями, благодаря его объективным психометрическим свойствам, определяющим устойчивость результатов повторного тестирования (коэффициент внутригрупповой корреляции равен 0,50) и минимальное клинически значимое различие (19 процентных пунктов). Амплитуда движения шейного отдела позвоночника (CROM) измерялась с помощью устройства измерения CROM (производства Performance Attainment Associates, Розвилл, Миннесота). На голову испытуемого надевали устройство измерения CROM, а на плечи – магнитный воротник, входящий в комплект устройства, для учета любого поворота туловища. Воротник всегда размещался в одном и том же положении по отношению к магнитному полюсу, при этом стул, на котором сидели участники, оставался в одном и том же положении на протяжении всего процесса сбора данных. Исходное положение головы устанавливалось как нейтральное на нулевой отметке инклинометра, предназначенного для фиксации сгибания, разгибания и двустороннего сгибания шеи. Для измерения поворотов круговая шкала также выставлялась на ноль, когда голова находилась в нейтральном положении. При движении головы в одном направлении показания конечной позиции по каждой попытке считывались и фиксировались. После считывания показаний на устройстве испытуемые возвращали голову в исход- ное положение. В каждом направлении было последовательно выполнено три испытания, и для анализа было рассчитано среднее значение по трем показаниям. Описанный метод является надежным методом измерения, обеспечивающим внутреннюю погрешность прибора в диапазоне от 0,70 до 0,90 и межприборную сходимость в диапазоне от 0,80 до 0,87.
Анализ данных
Статистический анализ проводился с использованием статистического ПО SPSS (производства SPSS Inc., Чикаго, Иллинойс; версия 20.0). Нормальное распределение переменной CROM устанавливалось с помощью критерия Шапиро-Уилка, кроме переменных ВАШ и NDI. Для анализа амплитуды движения шейного отдела позвоночника (CROM), а также социально-демографических данных субъектов (возраст и продолжительность боли) проводилась независимая проверка по критерию Стьюдента и односторонний дисперсионный анализ (односторонний ANOVA), в ходе которых проводилось сравнение исходных данных по двум группам. Расчеты проводились по принципу анализа в зависимости от назначенного лечения. По переменной CROM были выполнены двусторонние повторные измерения по внутрисубъектным-межсубъектным факторам взаимодействия ANOVA, при этом анализу подвергались такие факторы как группа (РЧГ в сравнении с ГП), время (до, после одного и после восьми сеансов) и взаимодействие «группа x время». При получении значимых результатов дисперсионного анализа в ходе многократных сравнений переменных выполнялся апостериорный анализ с введением поправок по методу Бонферрони. Для переменных ВАШ и NDI применялась непараметрическая статистика с последующим аномальным распределением. Для обобщения данных, включая выведение средних, среднеквадратичных отклонений, медиан и межквартильных размахов для непрерывных данных использовалась описательная статистика. Для внутригрупповых и межгрупповых сравнений приме- нялся U-критерий Манна-Уитни. Для анализа изменений внутригрупповых результатов использовался критерий Фридмана, а для апостериорных внутригрупповых сравнений – критерий Уилкоксона для связных выборок. При расшифровке полученных значений статистических критериев брался уровень значимости равный 5%.
РЕЗУЛЬТАТЫ
Для исследования по критериям возможного включения было отобрано двадцать шесть пациентов с миофасциальным болевым синдромом в трапециевидной мышце. Двадцать четыре пациента успешно завершили протокол исследования, из которых 14 были случайным образом назначены в РЧГ и заверши- ли протокол исследования (четверо мужчин, 10 женщин; средний возраст ± стандартное отклонение =31,8 ± 12,4 года) и 10 были распределены в ГП (шестеро мужчин, четыре женщины; средний возраст ± стандартное отклонение = 42,1 ± 12,6 лет). На рисунке 1 представлена блок-схема отбора и отсева. В таблице 1 в обобщенном виде представлены демографические и клинические характеристики участников в начале исследования. В исходном состоянии между демографическими и клиническими характеристиками участников двух групп не было никаких существенных различий. В ходе исследовании никаких нежелательных явлений не наблюдалось.
Оценка по шкале ВАШ
По РЧГ наблюдались статистически значимые различия между интенсивностью боли в исходном состоя- нии по сравнению со всеми периодами измерения (p < 0,001), чего не было отмечено по ГП. При межгрупповом сравнении различий по U-критерию Манна-Уитни обнаружено не было. Результаты по ВАШ сведены в таблицу 2.
Показатели по индексу инвалидности шеи
Улучшение индекса NDI наблюдалось в обеих группах, при этом статистически значимые различия были отмечены только после восьми сеансов (p < 0,05). При межгрупповом сравнении различий после восьми сеансов по U-критерию Манна-Уитни обнаружено не было. Результаты по индексу инвалидности шеи сведены в таблицу 2.
Показатели по амплитуде движения шейного отдела позвоночника (CROM)
Повторные измерения ANOVA не дали эффекта по времени на всем диапазоне движений шейного отдела позвоночника (сгибание F = 2,47; p = 0,101; разгибание F = 0,044; p = 0,957; hp2 = 0,003; боковое сгибание вправо F = 2,812; p = 0,076; hp2 = 0,158; боковое сгиба- ние влево F = 1,472; p = 0,246; hp2 = 0,089; вращение влево F = 0,713; p = 0,498; hp2 = 0,045) кроме вращения вправо (вращение вправо F = 4,112; p = 0,026; hp2 = 0,215). Взаимодействий «время х группа» обнаружено не было (сгибание F = 1,356; p = 0,273; hp2 = 0,083; разгибание F = 0,173; p = 0,842; hp2 = 0,011; боковое сгиба- ние вправо F = 0,198; p = 0,821; hp2 = 0,013. ; боковое сгибание влево F = 1,406; p = 0,261; hp2 = 0,086; вращение вправо F = 0,066; p = 0,936; hp2 = 0,004; вращение влево F = 0,425; p = 0,658; hp2 = 0,028). Сравнение внутригрупповых результатов по CROM представлено в таблице 3.
РАЗБОР РЕЗУЛЬТАТОВ
Цель исследования состояла в проведении оценки эффективности воздействия током монополярной емкостно-резистивной радиочастоты (MCRRF) (448 кГц) в лечении боли в шее в сравнении с процедурой плацебо воздействия. В большинстве исследований по влиянию радиочастоты на интенсивность боли группа плацебо не предусматривалась. По этой причине вопрос эффекта от плацебо-воздействия до сих пор оставался неизученным. Результаты, полученные в данном исследовании, позволяют предположить, что воздействие током РЧ потенциально может быть использовано для лечения миофасциального болевого синдрома в трапециевидной мышце шеи.
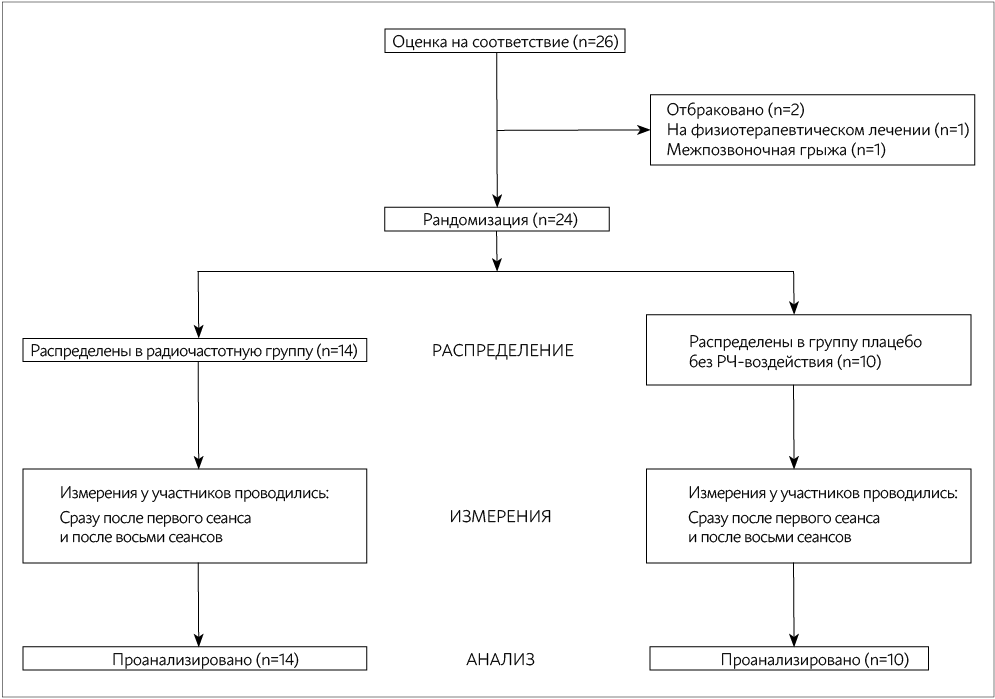
РИСУНОК 1: БЛОК-СХЕМА ИССЛЕДОВАНИЯ
Показатели по индексу инвалидности шеи
У пациентов из группы плацебо (ГП) наблюдалось значительное уменьшение интенсивности боли непосредственно после первого сеанса и после восьми сеансов. Величина изменений имела клинически важное значение в группе плацебо. Было установлено, что минимально обнаруживаемое изменение представляет собой снижение на 0,85 см, при этом после восьми сеансов снижение интенсивности боли по визуальной аналоговой шкале изначально составило от 2,9 см до 4,4 см. Кратковременные эффекты, полученные в ходе данного исследования, имеют чуть меньшую значимость, чем результаты, полученные группой Лламаса-Рамоса, где изменение от 4,3 до 5,3 см было обнаружено сразу после одного сеанса и через две недели во время наблюдения после прохождения пациентами курса иглорефлексотерапии в области трапециевидной мышцы. В то же время, группа Мехуто-Васкеса сообщает о наблюдаемом измене- нии от 1,9 см до 3,7 см сразу после одного сеанса и через одну неделю после прохождения курса терапии. Стоит при этом отметить, что результаты, получен- ные в ходе нашего исследования, превосходят результаты группы Сео, где пациенты проходили терапию в виде избирательной электростимуляции нервов средними токами и ботулинотерапию (БТА), хотя пациенты после терапии и наблюдались в течение 16 недель. Таким образом, по результатам предварительных клинических исследований токов РЧ можно сделать заключение, что данная технология имеет все шансы стать эффективной терапией по снижению боли в шее. При этом различия между группами пациентов не были клинически значимыми, что говорит о том, что в состав дальнейших исследований должны включаться другие виды показателей итоговой эффективности для более глубокой оценки влияния токов радиочастотного диапазона на снижение боли. В этом смысле было бы интересно провести оценку по таким итоговым показателям, как клинические измерения боли посредством прессорной альгометрии.
ТАБЛИЦА 1: ИСХОДНЫЕ ХАРАКТЕРИСТИКИ УЧАСТНИКОВ ИССЛЕДОВАНИЯ (ПАЦИЕНТОВ) ИЗ ОБЕИХ ГРУПП
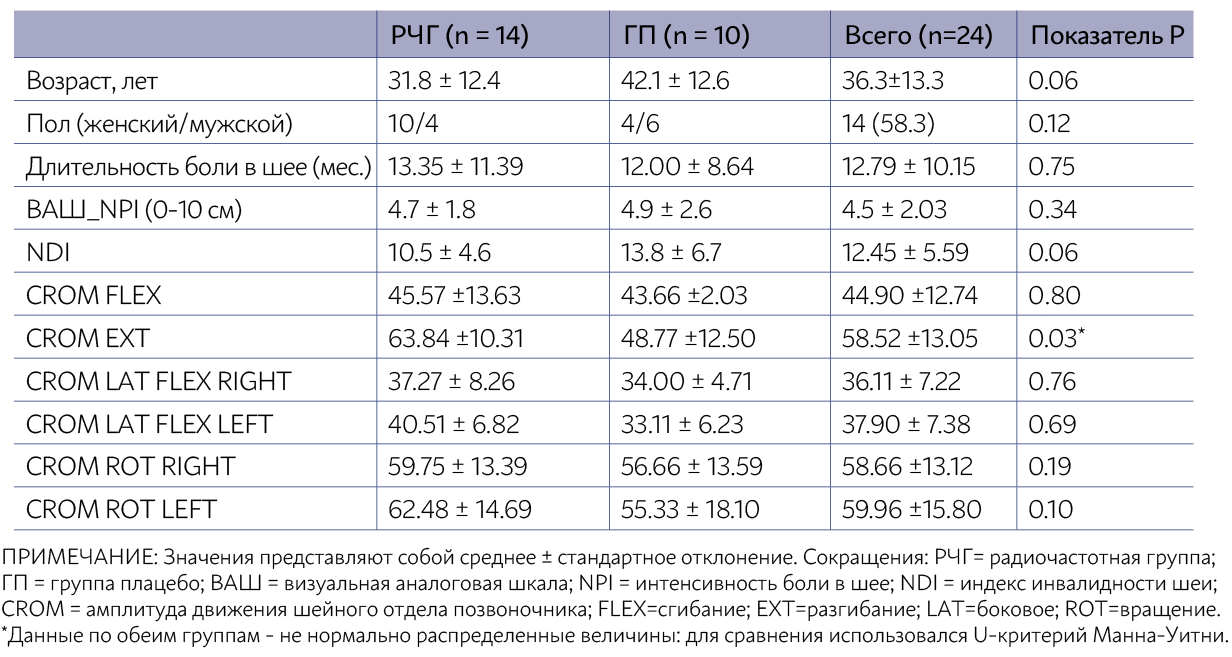
ТАБЛИЦА 2: ВНУТРИГРУППОВОЕ И МЕЖГРУППОВОЕ СРАВНЕНИЕ ИТОГОВЫХ ДАННЫХ ПО НЕПАРАМЕТРИЧЕСКИМ КРИТЕРИЯМ
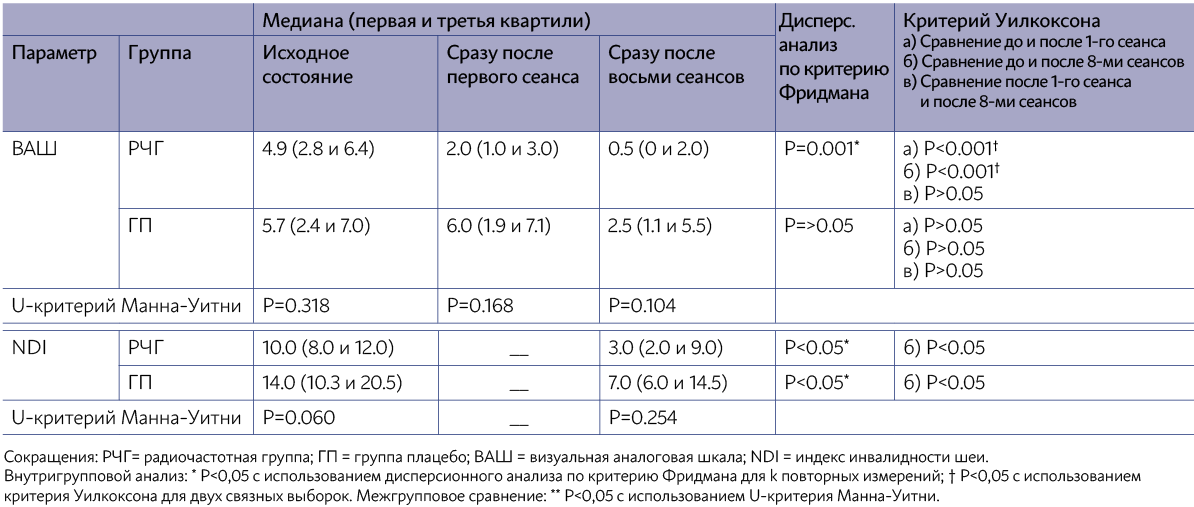
ТАБЛИЦА 3: АМПЛИТУДА ДВИЖЕНИЙ ШЕЙНОГО ОТДЕЛА ПОЗВОНОЧНИКА, ВЫРАЖЕННАЯ В ГРАДУСАХ, ПО ВРЕМЕНИ - ВНУТРИГРУППОВОЕ СРАВНЕНИЕ

Инвалидность шеи
В обеих группах наблюдалось снижение от исходного состояния после восьми сеансов, однако между группами существенных различий обнаружено не было. По имеющейся информации исследований по применению токов радиочастоты для лечения этого состояния ранее никогда не проводилось. В данном исследовании по РЧГ наблюдалось улучшение показателей на 40%. Обнаруженные изменения индекса инвалидности шеи не превышали минимального обнаруживаемого изменения (7,5 баллов по шкале NDI) (28). Также наблюдалось улучшение показателей по ГП на 30%. Наблюдаемый эффект плацебо скорее всего является психобиологическим явлением, обусловленным различными механизмами, включая ожидание клинического улучшения. В целом, эффект плацебо по-видимому представляет собой отличную модель для изучения взаимодействия сложной умственной деятельности, такой как ожидание, с различными нейронными системами.
Амплитуда движения шейного отдела позвоночника
После воздействия током монополярной емкостно-резистивной радиочастоты (MCRRF) и плацебо воздействия не наблюдалось значительного увеличения амплитуды движения шейного отдела, кроме вращений в правую сторону, при этом существенных различий между группами не было обнаружено. Показатели вращения шейного отдела в правую сторону значительно улучшились – на 8,1° после восьми сеансов в РЧГ и на 6,8° в группе плацебо. Со всей очевидностью можно сказать, что у пациентов РЧГ наблюдалось большее увеличение показателя вращения шейного отдела позвоночника вправо - плюс 2 градуса. Как указано ранее, в обеих группах было достигнуто минимальное обнаруживаемое изменение в 6,1° по показателю правого вращения. Насколько известно авторам, исследования воздействия монополярной емкостно-резистивной радиочастотной терапии, выбранной для лечения миофасциальной боли в шее, на амплитуду движения шейного отдела позвоночника проводятся впервые, однако полученные при этом результаты противоречат результатам предыдущих исследований, в которых наблюдалось увеличение амплитуды после применения других методов терапии, таких как иглорефлексотерапия триггерных зон, инъекции лидокаина и чрескожная электростимуляция нервов. Этиология миофасциальных триггерных зон неизвестна, но все же с помощью постулированного Симонсом каскада механизмов можно охарактеризовать три особенности, задействованные в механизмах миофасциальных триггерных зон, а именно: повышенное высвобождение ацетилхолина в двигательной конце- вой пластинке, высвобождение сенсибилизирующих веществ и увеличение напряжения мышечных волокон. Принимая во внимание предыдущую гипотезу, одним из правдоподобных объяснений полученных исследователями результатов является способность токов монополярной емкостно-резистивной РЧ вызывать вазодилатацию из-за повышения температуры, которая способствует восстановлению местного малокровия и гипоксии и уменьшает высвобождение сенсибилизирующих веществ и ацетилхолина. Токи РЧ стимулируют каскад воспалительных реакций, необходимый для удаления остатков кровоизлияния и вызова антиноцицептивного ответа. В нашем исследовании при наличии более 1 активной миофасциальной триггерной зоны для проведения вмешательства выбиралась наиболее активная зона с точки зрения гипералгезии. Тем не менее, воздействие токами РЧ не способствовало сокращению укорочения саркомера, учитывая отсутствие увеличения амплитуды движения шейного отдела у наших пациентов. При этом интенсивность боли уменьши- лась.
Факторы ограничения исследований
Основным фактором, ограничивающим исследования, является небольшой объем выборки. По этой причине результаты следует расшифровывать с должной осторожностью. Статистический анализ не показал различий между группами после вмешательства. Однако, по РЧГ наблюдались внутригрупповые различия. В дальнейших исследованиях для повышения статистической мощности следует увеличить объем выборки. Во-вторых, при двусторонней боли в шее терапевтическое воздействие оказывалось только на более болезненную сторону, что могло дать необъективную картину. Кроме того, в зависимости от сеанса может меняться локализация миофасциальных триггерных зон. В-третьих, проводилась терапия только одной мышцы, в связи с чем увеличение коли- чества мышц могло бы повлиять на изменение итого- вых показателей. В-четвертых, отсутствие последую- щего наблюдения является еще одним фактором, способствующим необъективности результатов, который необходимо учитывать в последующих исследованиях. В-пятых, мы не учитывали психологические показатели, а ведь эмоциональное состояние может повлиять на результаты. И наконец, процедура плаце- бо, используемая в рамках данного исследования, не прошла валидацию, поэтому ее результаты следует расшифровывать с осторожностью.
ЗАКЛЮЧЕНИЕ
Воздействие током монополярной емкостно-резистивной радиочастоты потенциально может повлиять на интенсивность боли. В радиочастотной группе интенсивность боли в шее у пациентов уменьшилась сразу после первого сеанса и после восьми сеансов монополярной емкостно-резистивной радиочастот- ной терапии (448 кГц). Кроме того, после восьми сеансов радиочастотной терапии и плацебо терапии наблюдалось улучшение по показателям индекса инвалидности шеи и правого вращения шейного отдела. При этом статистических различий между РЧГ и ГП в итоговых показателях не наблюдалось. Результаты данного пилотного исследования свидетельствуют о том, что РЧ не имеет побочных эффектов, поэтому в более развернутом комплексном исследовании можно брать в расчет представленную здесь электрическую дозу. В программу дальнейших исследований необходимо включить проведение оценки на этапе последующих наблюдений после терапии, а также предусмотреть дополнительные итоговые показатели для оценки эффективности и более круп- ные объемы выборки.
ЛИТЕРАТУРА
1. Punnett L, Wegman DH. Work-related musculoskeletal disorders:
the epidemiologic evidence and the debate. J Electromyogr Kinesiol.
2004;14(1):13-23.
2. Marley J, Tully MA, Porter-Armstrong A, Bunting B, O’Hanlon J, Mc-
Donough SM. A systematic review of interventions aimed at increasing
physical activity in adults with chronic musculoskeletal pain-protocol. Syst
Rev. 2014;3:106.
3. Smith BH, Elliott AM, Chambers WA, Smith WC, Hannaford PC,
Penny K. The impact of chronic pain in the community. Fam Pract.
2001;18(3):292-9.
4. Fejer R, Kyvik KO, Hartvigsen J. The prevalence of neck pain in the world
population: a systematic critical review of the literature. Eur Spine J.
2006;15(6):834-48.
5. Hogg-Johnson S, van der Velde G, Carroll LJ, Holm LW, Cassidy JD, Guz-
man J, et al. The burden and determinants of neck pain in the general
population: results of the Bone and Joint Decade 2000-2010 Task Force
on Neck Pain and Its Associated Disorders. J Manipulative Physiol Ther.
2009;32(2 Suppl): S46-60.
6. Côté P, Cassidy JD, Carroll LJ, Kristman V. The annual incidence and course
of neck pain in the general population: a population-based cohort study.
Pain. 2004;112(3):267-73.
7. Travell JG, Simons DG. Dolor y disfunción miofascial. Barcelona: Editorial
Médica Panamericana; 2004.
8. Fernández-de-las-Peñas C, Alonso-Blanco C, Miangolarra JC. Myofascial
trigger points in subjects presenting with mechanical neck pain: a blinded,
controlled study. Man Ther. 2007;12(1):29-33.
9. Seo BK, Lee JH, Kim PK, Baek YH, Jo DJ, Lee S. Bee venom acupuncture,
NSAIDs or combined treatment for chronic neck pain: study protocol for a
randomized, assessor-blind trial. Trials. 2014;15:132.
10.
of far-infrared irradiation on myofascial neck pain: a randomized, dou-
ble-blind, placebo-controlled pilot study. J Altern Complement Med.
2014;20(2):123-9.
11. Whipple T, Villegas D. Thermal and electric energy fields by noninvasive
monopolar capacitive-coupled radiofrequency: temperatures achieved
and histological outcomes in tendons and ligaments. PM R. 2010;2(7):599-
606.
12. Whipple TL. From mini-invasive to non-invasive treatment using monop-
olar radiofrequency: the next orthopaedic frontier. Orthop Clin North Am.
2009;40(4):531-5.
13. Weber T, Kabelka B. Noninvasive monopolar capacitive-coupled radiofre-
quency for the treatment of pain associated with lateral elbow tendinopa-
thies: 1-year follow-up. PM R. 2012;4(3):176-81.
14. Hayashi A. Getting athletes back in the game: a global view. AAOS Now.
2008;2(10):1-6.
15. Hernández-Bule ML, Paíno CL, Trillo MÁ, Úbeda A. Electric stimulation at
448 kHz promotes proliferation of human mesenchymal stem cells. Cell
Physiol Biochem. 2014;34(5):1741-55.
16. Simons DG, Travell JG, Simons LS. Dolor y disfunción miofascial: el man-
ual de los puntos gatillo. Barcelona: Editorial Médica Panamericana; 2001.
17. Calvo-Lobo C, Pacheco-da-Costa S, Martínez-Martínez J, Rodríguez-Sanz
D, Cuesta-Álvaro P, López-López D. Dry needling on the infraspinatus la-
tent and active myofascial trigger points in older adults with nonspecific
shoulder pain: a randomized clinical trial. J Geriatr Phys Ther. 2018;41(1):1-
13.
18.
needling on latent myofascial trigger points in older adults with nonspecif-
ic shoulder pain: a randomized, controlled clinical trial pilot study. J Geriatr
Phys Ther. 2017;40(2):63-73.
19. Myburgh C, Lauridsen HH, Larsen AH, Hartvigsen J. Standardized manual
palpation of myofascial trigger points in relation to neck/shoulder pain:
the influence of clinical experience on inter-examiner reproducibility. Man
Ther. 2011;16(2):136-40.
20. Moher D, Hopewell S, Schulz KF, Montori V, Gøtzsche PC, Devereaux PJ,
et al. CONSORT 2010 explanation and elaboration: updated guidelines for
reporting parallel group randomised trials. Int J Surg. 2012;10(1):28-55.
21.
pain scores vary with gender, age, or cause of pain? Acad Emerg Med.
1998;5(11):1086-90.
22. Kahl C CJ. Visual analogue scale, numeric pain rating scale and the McGill
pain questionnaire: an overview of psychometric properties. Phys Ther
Rev. 2005;10(2):123-8.
23. Emshoff R, Bertram S, Emshoff I. Clinically important difference thresh-
olds of the visual analog scale: a conceptual model for identifying mean-
ingful intraindividual changes for pain intensity. Pain. 2011;152(10):2277-
82.
24. Jensen MP, Turner JA, Romano JM, Fisher LD. Comparative reliability and
validity of chronic pain intensity measures. Pain. 1999;83(2):157-62
25. Katz J, Melzack R. Measurement of pain. Surg Clin North Am.
1999;79(2):231-52.
26. MacDermid JC, Walton DM, Avery S, Blanchard A, Etruw E, McAlpine C,
et al. Measurement properties of the neck disability index: a systematic
review. J Orthop Sports Phys Ther. 2009;39(5):400-17.
27. Cleland JA, Childs JD, Whitman JM. Psychometric properties of the Neck
Disability Index and Numeric Pain Rating Scale in patients with mechani-
cal neck pain. Arch Phys Med Rehabil. 2008;89(1):69-74.
28. Vernon H, Mior S. The Neck Disability Index: a study of reliability and va-
lidity. J Manipulative Physiol Ther. 1991;14(7):409-15.
29. Audette I, Dumas JP, Côté JN, De Serres SJ. Validity and between-day re-
liability of the cervical range of motion (CROM) device. J Orthop Sports
Phys Ther. 2010;40(5):318-23.
30. Llamas-Ramos R, Pecos-Martín D, Gallego-Izquierdo T, Llamas-Ramos
I, Plaza-Manzano G, Ortega-Santiago R, et al. Comparison of the short-
term outcomes between trigger point dry needling and trigger point man-
ual therapy for the management of chronic mechanical neck pain: a ran-
domized clinical trial. J Orthop Sports Phys Ther. 2014:44(11):852-61.
31. Mejuto-Vázquez MJ, Salom-Moreno J, Ortega-Santiago R, Truy-
ols-Domínguez S, Fernández-de-Las-Peñas C. Short-term changes
in neck pain, widespread pressure pain sensitivity, and cervical range of
motion after the application of trigger point dry needling in patients with
acute mechanical neck pain: a randomized clinical trial. J Orthop Sports
Phys Ther. 2014;44(4):252-60.
32. -
ulation on botulinum toxin a therapy in patients with chronic myofascial
pain syndrome: a 16-week randomized double-blinded study. Arch Phys
Med Rehabil. 2013;94(3):412-8.
33.
electrical nerve stimulation and electrical muscle stimulation on myofas-
cial trigger points. Am J Phys Med Rehabil. 1997;76(6):471-6.
34.
of electrotherapy on myofascial pain. J Back Musculoskelet Rehabil.
2002;16(1):11-6.
35. Gerwin RD, Dommerholt J, Shah JP. An expansion of Simons’ integrat-
ed hypothesis of trigger point formation. Curr Pain Headache Rep.
2004;8(6):468-75.
36. Simons DG. Review of enigmatic MTrPs as a common cause of enig-
matic musculoskeletal pain and dysfunction. J Electromyogr Kinesiol.
2004;14(1):95-107.

