Реакция раковых клеток человека на одновременное воздействие сорафениба и радиочастотного тока
МАРИЯ ЛУИЗА ЭРНАНДЕС БУЛЕ, МАРИЯ АНТОНИЯ МАРТИНЕС, МАРИЯ АНХЕЛЕС ТРИЛЛО, ЛИДИЯ МАРТИНЕС, ЕЛЕНА ТОЛЕДАНО МАСИАС и АЛЕХАНДРО УБЕДА
Служба исследований биоэлектромагнетизма, Университетская больница Рамона-и-Кахаля, ИРИСИС, Мадрид 28034, Испания
Получено 16 февраля 2021 г.; Принято 24 августа 2021 г.
DOI: 10.3892/ol.2021.13068
Аннотация.
В связи с предполагаемым обезболивающим, противовоспалительным и регенеративным действием на ткани, ёмкостно-резистивная электротермическая терапия (CRET) на основе неинвазивного воздействия радиочастотными (RF) токами часто применяется к онкологическим пациентам, получающим химиотерапевтическое лечение. Наши предыдущие исследования продемонстрировали, что субтермальные токи CRET-терапии могут вызывать ряд клеточных ответов, в том числе с антипролиферативным действием, в клеточной линии рака печени человека HepG2. Данные эффекты включают в себя значительные изменения в регуляции белков, участвующих в сигнальных путях MAPK, которые также вовлечены в реакцию раковых клеток на стандартные противоопухолевые препараты типа сорафениба. Совпадение путей реагирования может привести к конкурентным, нейтрализующим или блокирующим взаимодействиям между электро- и химиотерапией, что поднимает вопрос о целесообразности применения CRET как обезболивающего, противовоспалительного или иного средства у пациентов, проходящих химиотерапию. В данном исследовании проанализировано влияние одновременного воздействия сорафениба и субтермального CRET-тока частотой 448 кГц на пролиферацию и жизнеспособность клеточных культур линии HepG2. Жизнеспособность клеток определяли с помощью окрашивания трипановым синим или XTT-тестов, а для анализа клеточного цикла и апоптоза применяли метод проточной цитометрии. Экспрессию белков, участвующих в клеточной пролиферации, оценивали методами иммуноблоттинга и реакции иммунофлюоресценции. В результате не выявлено никакого свидетельства того, что данный метод электротерапии противодействовал или нейтрализовал клеточный ответ на сорафениб при различных оцениваемых состояниях. Более того, при стандартной фармакологической концентрации сорафениба в 5 мкмоль комбинированная терапия вызывала значительно более сильный антипролиферативный ответ, чем тот, который вызывался каждым из методов терапии при раздельном применении в клетках линии HepG2. Эти данные не подтверждают гипотезу о том, что воздействие CRET-терапии может ингибировать или ослаблять действие химиотерапевтического препарата, используемого при лечении рака, и подчеркивают необходимость дальнейшего изучения реакции клеток на комбинированное воздействие электро- и химиотерапии.
Вступление
Ёмкостно-резистивная электротермическая терапия (CRET) основана на неинвазивном воздействии радиочастотными (RF) токами диапазона 0,45-0,60 МГц, которые при циркуляции через обрабатываемые ткани вызывают повышение температуры вследствие эффектов переориентации ионов и трения (1). Данный метод терапии успешно применяется для восстановления кожных, мышечных и костно-суставных тканей (2,3), а также при лечении артрита (4), болезни Пейрони (5) и заболеваний, связанных с нарушением кровообращения (6,7).
Имеются указания на то, что определенную роль в терапевтическом воздействии RF токов также может играть индукция клеточных ответов субтермального или микротермального характера. Действительно, наши предыдущие исследования показали, что электротоки, используемые в CRET-терапии, при применении in vitro в субтермальных дозах могут оказывать значительное влияние на пролиферацию (8), дифференцировку (9,10) и жизнеспособность различных типов клеток человека (1). Обнаружено, что эти эффекты, по-разному проявляющиеся в различных типах клеток и нелинейно зависящие от параметров RF сигнала (частота, модуляция и плотность тока), опосредуются электрически наведенными изменениями в регуляции белков, участвующих в вышеупомянутых процессах (11,12). Установлено, что токи CRET-терапии индуцируют антипролиферативные и (или) цитотоксические ответы в раковых клетках (11,13-15).
Сигнальный каскад Ras/Raf/RAF)/MEK/ERK играет основную роль в регулировании пролиферации клеток печени (16), и ранее отмечалось, что изменения в этом пути участвуют в развитии гепатоцеллюлярной карциномы (ГЦК) (17). Исходя из этого, ингибирование сигнального пути Ras/ERK считается обоснованным подходом к лечению ГЦК. При этом мультикиназный ингибитор сорафениб является единственным системно-применяемым химиотерапевтическим средством, одобренным Управлением по контролю за продуктами и лекарствами США для стандартизированного лечения ГЦК (18,19). Сорафениб действует преимущественно посредством ингибирования путей, участвующих в выживании клеток и ангиогенезе, таких как пути VEGFR (рецептора ФРЭС) или PDGFR (рецептора фактора роста тромбоцитов) (20), а также пути киназ Raf, в которых сорафениб ингибирует фосфорилирование MEK и ERK (16). В клеточной линии человека HepG2 CRET оказывает антипролиферативное и дифференцирующее действие посредством изменений в регуляции различных белков, включая циклины, ингибиторы циклинзависимой киназы или киназы путей MAPK типа ERK1/2 (1,9,21).
Таким образом установлено, что как CRET, так и сорафениб ингибируют пролиферацию клеток HepG2 за счёт воздействия на элементы сигнального пути Ras/ERK. Взаимовлияние между электрическими и химическими путями реагирования приводит к возможности конкурентных, нейтрализующих или блокирующих взаимодействий между обоими типами терапии. Возможное существование взаимодействий такого характера вызывает сомнения в целесообразности назначения онкологическим пациентам CRET-терапии как обезболивающего, противовоспалительного, заживляющего или иного средства во время прохождения химиотерапии. Целью данного исследования было проведение анализа эффектов одновременного применения in vitro сорафениба и CRET с частотой электротока 448 кГц на пролиферацию и жизнеспособность клеточной линии HepG2. Полученные результаты не выявили никаких свидетельств, которые позволяли бы предположить, что воздействие электротока противодействовало или нейтрализовало клеточный ответ на сорафениб в различных условиях испытаний. Напротив, при определенных условиях комбинированная терапия вызывала значительно более существенный антипролиферативный ответ, чем тот, который вызывался каждым из методов терапии при применении их по отдельности.
Материалы и методы
Клеточная культура. Линия клеток рака печени человека HepG2 получена из Европейской коллекции аутентифицированных клеточных культур (кат. № 85011430). Клетки высевали в тарированные колбы объемом 75 см2 (Falcon; Corning Life Sciences) в DMEM (минимальной эссенциальной среде) (Gibco; Thermo Fisher Scientific, Inc.) с добавлением 10% (об./об.) фетальной бычьей сыворотки (ФБС; Gibco; Thermo Fisher Scientific, Inc.), 4 мм L-глютамина (Gibco; Thermo Fisher Scientific, Inc.) и 100 ед/мл пенициллина-стрептомицина с фунгизоном (Gibco; Thermo Fisher Scientific, Inc.) и инкубировали в атмосфере с 5%-ным CO2 при 37°C. Культуры подвергали трипсинизации и субкультивированию один раз в неделю.
Процедуры обработки. Процедура и материалы CRET-воздействия описаны в предыдущих исследованиях (1,13). Вкратце, клетки высевали в чашки Петри диаметром 60 мм (Nunc; Thermo Fisher Scientific, Inc.) при плотности 105 клеток/мл. Чашки разделили на четыре группы: Контрольные клетки, обработанные симулятивно, инкубировали в присутствии обесточенных электродов, клетки, обработанные только с помощью CRET, клетки, обработанные только сорафенибом, и клетки, одновременно обработанные сорафенибом + CRET. На 4-й день после посева, когда было достигнуто слияние в 70-80%, культуры подвергали электрической или химической обработке или и той, и другой. Исходя из ранее опубликованных данных об ответе клеток линии HepG2 на сорафениб (22,23), клетки обрабатывали сорафенибом в течение 48 часов в концентрациях 3 мкмоль, 5 мкмоль или 7 мкмоль с использованием DMSO (диметилсульфоксида) (Gibco; Thermo Fisher Scientific, Inc.) в разведении 1:1000 в DMEM с 10%-ным содержанием ФБС в качестве несущей среды. При одновременной электрической и химической обработке на 4-й день после посева, после добавления сорафениба, во все чашки, как обработанные, так и контрольные, были вставлены электроды из нержавеющей стали, специально разработанные для CRET-терапии. Обработку синусоидальным током с частотой 448 кГц и 50 мкА/мм2 проводили циклически (5 мин вкл./235 мин выкл.) в общей сложности в течение 24 часов с использованием источника питания CRET-системы Indiba Activ HCR 902 (Indiba S.A.). Затем все культуры инкубировали еще в течение 24 часов при отсутствии электрической стимуляции. Для экспериментов по вестерн-блоттингу образцы подвергали короткой 4-часовой комбинированной обработке. По окончании химического и (или) электрического воздействия образцы обрабатывали для проведения соответствующих анализов.
Анализ жизнеспособности клеток путем количественного определения окрашиванием трипановым синим. Клетки трипсинизировали 0,25%-ным раствором трипсина (Gibco; Thermo Fisher Scientific, Inc.) и разводили в 1 мл культуральной среды с добавлением DMEM. Аликвоты этого раствора окрашивали 0,4% трипановым синим (Sigma Aldrich; Merck KGaA), разведенным 1:4 в ФСБ (Gibco) и подсчитывали в камере Нойбауэра для оценки жизнеспособности клеток.
Анализ жизнеспособности XTT. Жизнеспособность клеток определяли методом XTT-анализа (Roche Diagnostics GmbH). После симулятивной, электрической, химической или одновременной обработки клетки инкубировали в течение 3 часов с тетразолиевой солью XTT при температуре 37°C в атмосфере с 6%-ным CO2, как рекомендовано производителем. Метаболически активные клетки превращали XTT в окрашенные формазановые соединения, которые количественно определяли с помощью считывателя микрочашек (Tecan) при длине волны 492 нм.
Иммунофлуоресцентная оценка маркера пролиферации Ki67. Иммунофлуоресцентный анализ на Ki67 проводили на клетках, культивируемых на покровных стеклах. В конце 48-часового периода обработки клетки фиксировали 4%-ным параформальдегидом и пермеабилизировали 95/5 (об./об.) этанолом/уксусной кислотой. Клетки инкубировали в течение ночи при температуре 4°С с моноклональным первичным антителом, анти-Ki67 (SP6; 1:250, кат. № ab16667; Abcam). Затем добавляли вторичное антитело Alexa Fluor® 488, конъюгированное с козьим анти-кроличьим IgG (1:500; кат. № A11034; Thermo Fisher Scientific, Inc.) и инкубировали образцы при комнатной температуре в течение 1 часа. Препараты подвергали обратному окрашиванию, помещали в реагент для предотвращения выгорания флуоресценции ProLong™ Gold с DAPI (кат. № P36941; Thermo Fisher Scientific, Inc.) и наблюдали с помощью инвертированного флуоресцентного микроскопа (Nikon Eclipse Ts2R; Корпорация Nikon), подключенного к цифровой камере DS Ri2 (Корпорация Nikon). Записывались изображения из трех экспериментальных копий, и клетки Ki67+, а также общее количество клеток подсчитывали с помощью ПО NIS Elements Br image (версия 4.40; Корпорация Nikon). Идентификация клеток Ki67+ была основана на фиксированных порогах флуоресценции, определенных и автоматизированных в начале анализа. При каждом повторении эксперимента анализировали 15 полей микроскопа в зависимости от условий эксперимента.
Анализ клеточного цикла методом проточной цитометрии с использованием йодида пропидия. После трипсинизации клетки центрифугировали, ресуспендировали в 70%-ном этаноле и фиксировали при температуре 4°C в течение ≥24 часов. Чтобы обнаружить апоптотические клетки, которые могли быть суспендированы в культуральной среде, среду со всех чашек собирали и центрифугировали. Полученные гранулы обрабатывали вместе с остальными ячейками на чашках. Для мечения йодидом пропидия клетки ресуспендировали и окрашивали раствором 3,4 ммоль цитрата натрия (PanReac Quimica SLU), 100 мкг/мл РНКазы А (Roche Diagnostics GmbH) и 20 мкг/мл йодида пропидия (Roche Diagnostics GmbH) и инкубировали в темноте при комнатной температуре в течение 1 часа. Для сбора данных было подсчитано в общей сложности 20 000 событий с использованием FACScan Mod и проточного цитометра FACSCalibur (BD Biosciences). Полученные данные были проанализированы с помощью ПО CellQuest 3.2 (BD Immunocytometry Systems).
Оценка ядерного антигена пролиферирующих клеток (PCNA), циклина D1, фосфорилированного p ERK1/2, ERK1/2, p-РЭФР и экспрессии РЭФР (Рецептора эпидермального фактора роста) методом вестерн-блоттинга. В конце каждой экспериментальной репликации образцы клеток центрифугировали и лизировали в буфере для лизиса, содержащем 10 ммоль Трис Hcl (трис-гидроксиметиламинометана гидрохлорида) (Merck KGaA) рН 7,6, 10 ммоль KCl (Merk KGaA), 1 мм дитиотрейтола (Sigma Aldrich; Merck KGaA), 1 ммоль ЭДТА (Bio Rad Laboratories, Inc.), 1 ммоль PMSF (Sigma Aldrich; Merck KGaA), 10 мкг/мл лейпептина (Sigma Aldrich; Merck KGaA), 5 мкг/мл пепстатина (Sigma Aldrich; Merck KGaA), 100 ммоль NaF (Sigma Aldrich; Merck KGaA), 20 ммоль β-глицерофосфата (Calbiochem; Merck KGaA), 20 ммоль молибдата натрия (Sigma Aldrich; Merck KGaA), 0,5% Triton X 100 (ICN Biomedicals, Inc.) и 0,1% SDS (Bio Rad Laboratories, Inc.). Концентрацию белка определяли с помощью анализа белкового спектра Pierce BCA (Thermo Fisher Scientific, Inc.). Затем образцы белка (аликвоты белка по 100 мкг) разделяли в 8-10%-ном растворе ДСН-ПААГ и электрофоретически переносили на нитроцеллюлозные мембраны (Amersham; Cytiva) с использованием полусухой системы переноса клеток (Trans Blot® SD semi dry transfer cell; Bio Rad Laboratories, Inc.). Блоты инкубировали при температуре 4°С в течение ночи в присутствии следующих антител: Мышиное моноклональное первичное антитело к циклину D1 (1:1000; кат. № P2D11F11; Novocastra Laboratories Ltd.), мышиное моноклональное антитело к PCNA (1:1000; кат. № sc 56; Santa Cruz Biotechnology, Inc.), кроличье поликлональное первичное антитело к p-EGFR (1:1000; кат. № 3777; Cell Signaling Technology, Inc.), мышиное моноклональное первичное антитело к EGFR (1:1000; кат. № MA5-13877; Thermo Fisher Scientific, Inc.), кроличье поликлональное первичное антитело к ERK1/2 (1:1000; кат. № 9102S; Thermo Fisher Scientific, Inc.) и кроличье поликлональное первичное антитело к p-ERK1/2 (1:1000; кат. № 44-680G; Thermo Fisher Scientific, Inc.). В качестве контроля загрузки использовали моноклональное мышиное антитело к β-актину (1:5000; A5441; Sigma Aldrich; Merck KGaA). Для выявления нефосфорилированных форм ERK1/2 мембраны очищали 25 ммоль глицином при рН 2,0 в течение 30 мин. Представляющие интерес белки были обнаружены с использованием вторичных антител, конъюгированных с пероксидазой хрена, в течение 1 ч при комнатной температуре (ECL ослиное анти-кроличье; 1:3000; кат. № NA934; овечье анти-мышиное; 1:5000; кат. № NA931; или IgG- цельное антитело, связанное с пероксидазой из хрена; все из Cytiva) или флуоресцентно помеченное вторичное антитело (поликлональное вторичное антитело IRDye® 800 CW козье анти-кроличье; 1:10 000; кат. № 926-32211; LI COR Biosciences) в тех же условиях инкубации. Система визуализации ChemiDoc (Bio Rad Laboratories, Inc.) использовалась для обнаружения ECL (энтерохромаффиноподобных клеток) в блотах, в то время как обнаружение фосфорилированных форм РЭФР (p-РЭФР) осуществлялось с помощью иммунофлуоресцентного анализа с помощью системы Odyssey (LI COR Biosciences). Все изображения анализировались с помощью программного обеспечения Quantity One (версия 4.6.7; Bio Rad Laboratories, Inc.).
Статистический анализ. Статистические различия между группами определяли Однофакторным дисперсионным анализом с последующим проведением ретроспективных анализов Бонферрони или с помощью непарного параметрического t-критерия Стьюдента с использованием ПО GraphPad Prism 6.01 (GraphPad Software, Inc.). На каждый эксперимент и интервал воздействия было проведено по меньшей мере три независимых повторения. Результаты были выражены в виде среднего значения ± SD или SEM. Считалось, что Р<0,05 указывает на статистически значимую разницу.
Результаты
Влияние сорафениба на жизнеспособность клеток при назначении в различных концентрациях. Предварительный отбор концентраций сорафениба, подходящих для комбинированного лечения с CRET-терапией, проводили с использованием метода исключения трипанового синего для определения жизнеспособности клеток. После 48 часов терапии сорафениб подавлял жизнеспособность клеток и увеличивал гибель клеток дозозависимым образом (рис. 1А и Б). Половинная максимальная ингибирующая концентрация (IC50) сорафениба, определенная методом нелинейного регрессионного анализа с использованием программного обеспечения Excel (Microsoft Excel 2013, 15.0.4945.1000, 32 бита), составила 7 мкмоль (рис. 1С).
Влияние CRET и сорафениба на жизнеспособность клеток. Эффекты химической и электрической терапии, назначаемых по отдельности или в комбинации, были количественно оценены с помощью трипанового синего через 48 часов после начала терапии. Результаты анализа трипановым синим (Рис. 1D) показали, что при индивидуальном применении как воздействие CRET, так и химическая обработка в различных концентрациях значительно снижали жизнеспособность клеток по сравнению с соответствующими контрольными образцами. При комбинированной терапии воздействие CRET существенно не влияло на снижение жизнеспособности клеток, индуцированное 3 или 7 мкмоль сорафениба. Однако при промежуточной концентрации в 5 мкмоль, которая при отдельном применении вызывала снижение жизнеспособности, эквивалентное снижению, вызванному только CRET-терапией (~85% от значения в контрольных группах), комбинированное воздействие приводило к снижению жизнеспособности, значительно большему, чем при химической обработке (~70% от значения в контрольных группах).
Результаты XTT, приведенные в дополнительных данных (Рис. S1), показали, что этот метод менее чувствителен, чем трипановый синий, для выявления влияния CRET на жизнеспособность клеток линии HepG2. Об этой низкой чувствительности анализа XTT сообщалось ранее при описании влияния противораковых препаратов, таких как сорафениб (который способен индуцировать образование активных форм кислорода), на жизнеспособность клеток линии HepG2 (24). Основываясь на этих результатах, в настоящем исследовании отказались от использования XTT и других анализов, которые оценивают метаболическую функцию клеток путем восстановления тетразолиевых солей до формазана. Последующие эксперименты были сосредоточены на реакции клеток линии HepG2 на воздействие CRET в присутствии 5 мкмоль сорафениба (IC15).
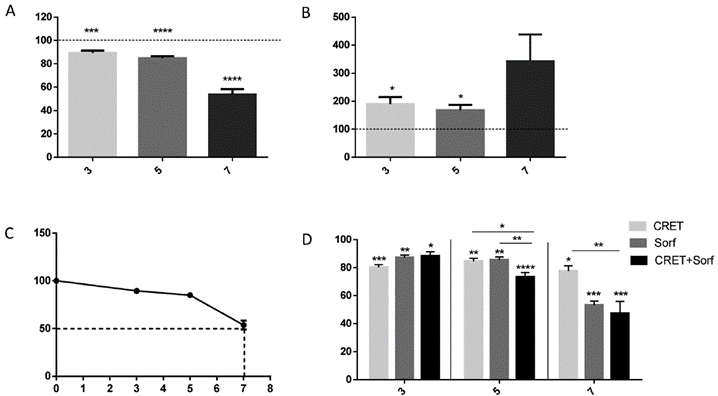
Рисунок 1. Влияние CRET-терапии и/или сорафениба на жизнеспособность клеток линии HepG2. (A) Живые и (B) мертвые клетки после 48 часов лечения различными концентрациями сорафениба. (C) Определение половины максимальной ингибирующей концентрации. (D) Жизнеспособность клеток после обработки только CRET-терапией (50 мкА мм2; 24 часа периодического воздействия + 24 часа после воздействия), только сорафенибом (3,7 мкмоль; 48 часов) или комбинированным (CRET + сорафениб). Данные представлены в виде среднего значения ± SD для ≥3 повторов экспериментов на концентрацию. Значения были нормализованы к соответствующим контрольным группам. *Р<0,05, **Р<0,01, ***Р<0,001 и ****Р<0,0001. Данные были статистически проанализированы с помощью Однофакторного дисперсионного анализа с последующим ретроспективным анализом Бонферрони. CRET, емкостно-резистивная электротермическая терапия; Sorf, сорафениб.
Влияние CRET и сорафениба на экспрессию белков, участвующих в клеточной пролиферации. Эффекты CRET и сорафениба на пролиферацию клеток оценивали с помощью анализа экспрессии PCNA и белка Ki67. Экспрессию PCNA анализировали через 4 и 48 часов после обработки. Через 4 часа только образцы, подвергнутые комбинированной обработке, показали незначительное снижение экспрессии PCNA по сравнению с контрольными образцами. Через 48 часов образцы, обработанные сорафенибом, либо в присутствии, либо в отсутствие CRET-терапии, показали эквивалентные, статистически значимые снижения экспрессии PCNA. При отдельном применении, электрическая обработка существенно не влияла на экспрессию PCNA после 4 или 48 часов воздействия (Рис. 2A и B). После 2 дней обработки количество клеток, экспрессирующих маркер пролиферации Ki67, значительно уменьшилось в образцах, подвергнутых комбинированной обработке, и в образцах, подвергнутых раздельной химической или физической обработке, по сравнению с таковым в контрольных группах. Эффект комбинированной обработки был значительно сильнее, чем при применении только CRET (Рис. 2C и D).
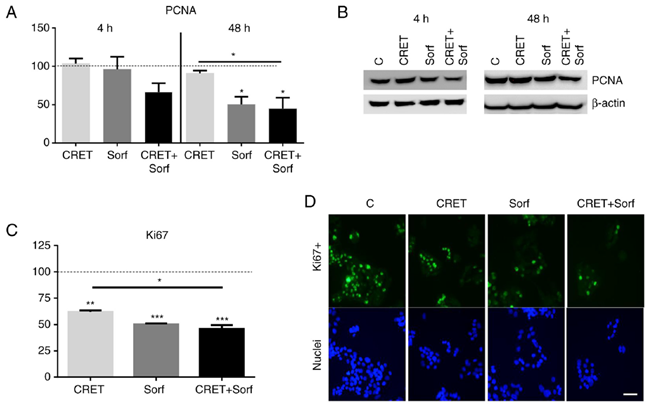
Рисунок 2. Влияние CRET-терапии и/или сорафениба на экспрессию маркеров пролиферации, PCNA и Ki67. (А) Метод вестерн-блоттинга экспрессии PCNA после только CRET-терапии (4 или 24 часа периодического воздействия + 24 часа после воздействия), только сорафенибом (4 или 48 часов) или в комбинации. Данные представлены в виде отношения PCNA к β-актину (PCNA/β-актину). Все значения представляют собой среднее значение ± SEM для ≥3 повторов экспериментов. *Р<0,05. (B) Репрезентативные вестерн-блоты с использованием β-актина в качестве контроля загрузки. (C) Иммунофлуоресценция экспрессии Ki67. Клетки обрабатывали только CRET (24 ч + 24 ч после воздействия), только сорафенибом (48 ч) или в комбинации. *Р<0,05, **Р<0,01 и ***Р<0,001. Данные были статистически проанализированы с помощью Однофакторного дисперсионного анализа с последующим ретроспективным анализом Бонферрони. (D) Репрезентативные изображения иммунофлуоресценции для Ki67. Зеленым цветом обозначены Ki67-позитивные клетки, окрашенные антителом против Ki67 и Alexa Fluor® 488. Синим цветом обозначены ядра, окрашенные DAPI. Масштабная линейка, 50 мкм; одинаковый масштаб на всех микрофотографиях. CRET, емкостно-резистивная электротермическая терапия; PCNA - ядерный антиген пролиферирующих клеток; Sorf - сорафениб; C - контрольная группа.
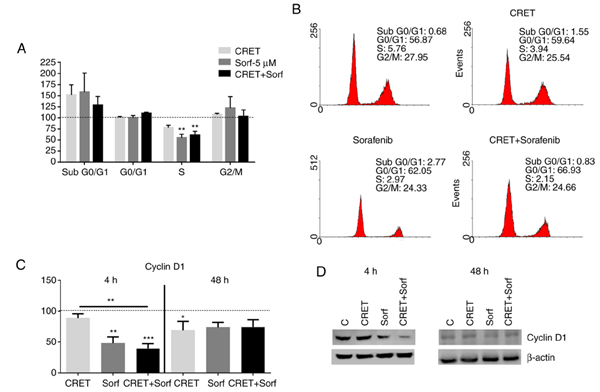
Рисунок 3. Влияние CRET-терапии и/или сорафениба на апоптоз и клеточный цикл. (А) Анализ методом проточной цитометрии образцов, обработанных только CRET-терапей (24-часовое промежуточное воздействие + 24 часов после воздействия), только сорафенибом (48 часов) или в комбинации. Данные представлены в процентах от среднего значения ± SEM для ≥3 повторов экспериментов и нормализованы к соответствующим контрольным группам. **P<0,01. (B) Репрезентативные гистограммы проточной цитометрии клеток линии HepG2, обработанных йодидом пропидия. Вестерн-блоттинг экспрессии циклина D1 после только CRET-терапии (4 или 24 часа периодического воздействия + 24 часа после воздействия), только сорафенибом (4 или 48 часов) или в комбинации. Данные представлены в виде отношения циклина D1 к бета-актину (циклин D1/β-актин). Данные представлены в виде среднего значения ± SEM для ≥3 повторов экспериментов. *Р<0,05, **Р<0,01 и ***Р<0,001. Данные были статистически проанализированы с помощью Однофакторного дисперсионного анализа с последующим ретроспективным анализом Бонферрони. (B) Репрезентативные вестерн-блоты с использованием β-актина в качестве контроля загрузки. CRET - емкостно-резистивная электротермическая терапия; C - контрольная группа; Sorf - сорафениб.
Влияние CRET и сорафениба на апоптоз и клеточный цикл. Чтобы идентифицировать процессы, лежащие в основе наблюдаемого снижения жизнеспособности клеток, потенциальные эффекты вышеупомянутых воздействий на клеточный цикл или апоптоз проанализировали методом проточной цитометрии с использованием окрашивания йодидом пропидия. Данные, отображенные на рис. 3, показали, что скорость апоптоза (фаза ниже G0/G1) существенно не повышалась в ответ на раздельную терапию CRET или 5 мкмоль сорафениба, а также на комбинированную терапию. Однако ожидается, что биологическая значимость этих потенциальных проапоптотических эффектов будет довольно ограниченной, поскольку типичные показатели спонтанного апоптоза в клеточной линии HepG2 являются заметно низкими (1,3% в контрольной группе). Анализ клеточного цикла показал, что электрическая обработка уменьшила, хотя и незначительно, долю клеток в S-фазе. Сорафениб при назначении отдельно или в комбинации с CRET значительно снижал количество клеток в S-фазе по сравнению с результатами в контрольной группе и в образцах, обработанных только с помощью CRET (Рис. 3А, В и S2).
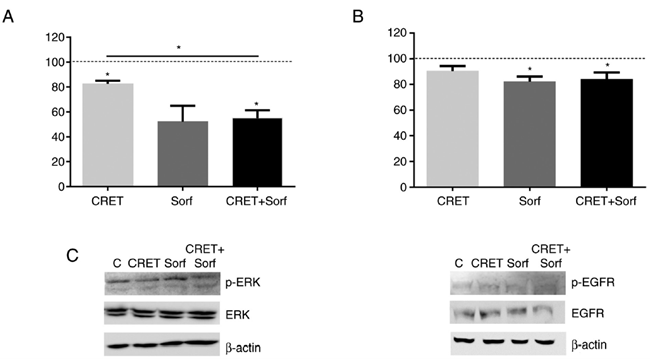
Рисунок 4. Влияние CRET-терапии и/или сорафениба на экспрессию и активацию РЭФР и ERK. Представлены результаты вестерн-блоттинга для определения p-ERK, ERKK, p-РЭФР и экспрессии РЭФР. Образцы обрабатывали только CRET-терапией (периодическое воздействие 4 часа), только сорафенибом (4 часа) или в комбинации. Данные представлены в виде соотношения (А) p ERK1/2 к общему белку ERK1/2 и (Б) p-РЭФР к общему белку РЭФР. Данные представлены в виде среднего значения ± SEM для ≥3 повторов экспериментов. *Р<0,05. Данные были статистически проанализированы с помощью Однофакторного дисперсионного анализа с последующим ретроспективным анализом Бонферрони. (B) Репрезентативные вестерн-блоты с использованием β-актина в качестве контроля загрузки. CRET - емкостно-резистивная электротермическая терапия; p - фосфорилированный; Sorf - сорафениб; C - контрольная группа.
На основании этих результатов была проанализирована экспрессия циклина D1, регуляторного белка, который участвует в развитии клеточного цикла от G1-фазы к S-фазе. Через 4 часа, обработка сорафенибом, применяемым отдельно или в комбинации с CRET, значительно снижала экспрессию циклина D1 по сравнению с контрольной группой, и эффект комбинированной обработки был значительно сильнее, чем при применении только CRET. В конце 48-часовой обработки только электрическая обработка вызывала значительное снижение экспрессии циклина D1 (Рис. 3C и D).
Влияние сорафениба и CRET на ERK1/2 и РЭФР. Для изучения потенциального раннего вовлечения сигнального пути MAPK/ERK1/2 в наблюдаемых эффектах на жизнеспособность клеток, экспрессия нефосфорилированной и фосфорилированной форм ERK1/2 и РЭФР в ответ на кратковременное лечение была проанализирована методом вестерн-блоттинга. После 4-часового воздействия электрическая обработка снижала фосфорилирование ERK1/2 (p ERK1/2 по сравнению с общим белком ERK1/2). Это снижение было значительно выше при комбинированной обработке (Рис. 4А и В). С другой стороны, электрическая обработка существенно не повлияла на экспрессию фосфорилированного рецептора (p-РЭФР по сравнению с общим белком РЭФР). Напротив, сорафениб и комбинировання обработка значительно снижали экспрессию фосфорилированного рецептора по сравнению с контрольной группой (Рис. 4B и C).
Обсуждение
Электротермические CRET-терапии в настоящее время используются из-за их заявленного обезболивающего, противовоспалительного и регенеративного действия на ткани. Тот факт, что эти методы терапии часто рекомендуются пациентам, страдающим раком, которые также проходят химиотерапию, подчеркивает необходимость расширения имеющихся в настоящее время недостаточных знаний о потенциальных взаимодействиях между электрической и химической терапиями. В настоящем исследовании изучались эффекты одновременного лечения химиотерапевтическим препаратом сорафениб и субтермальным током частотой 448 кГц на пролиферацию и жизнеспособность линии клеток рака печени HepG2. Наши предыдущие исследования показали, что радиочастотные токи, используемые в CRET-терапии, могут сами по себе и в субтермальных условиях индуцировать потенциальные терапевтические ответы, такие как пролиферация и дифференцировка клеток в стволовых клетках, полученных из жировой ткани человека (8-10). Субтермальные CRET-терапии также могут оказывать антипролиферативное и/или цитотоксическое действие на клеточные линии нейробластомы и ГЦК путем изменения экспрессии белков, участвующих в сигнальном пути MAPK/ERK1/2 (11,21). Этот путь, при его ингибировании сорафенибом, сдерживает пролиферацию клеток и индуцирует апоптоз в клетках ГЦК (17,25). Таким образом, является возможным, что, при воздействии на взаимную молекулярную мишень, между химиотерапевтическими препаратами и радиочастотными токами CRET могут возникать синергетические, дополнительные, усиливающие, нейтрализующие или блокирующие взаимодействия. Такая возможность поднимает вопросы об удобстве одновременного применения на пациентов, страдающих раком и проходящих химиотерапию, CRET-терапии для обезболивающих, противовоспалительных или других целей.
Настоящие результаты подтверждают ранее опубликованные наблюдения о том, что при раздельном применении субтермальная CRET-терапия (1,21,26) и сорафениб (27,28) могут значительно снижать жизнеспособность раковых клеток печени. Кроме того, представленные данные показали, что при концентрации сорафениба 5 мкмоль снижение жизнеспособности линии HepG2 после комбинированной CRET + сорафениб терапии было значительно большим, чем при применении CRET или сорафениба по отдельности. Это вызвало предположения о совместном эффекте обоих методов терапии, при их сочетании, который не мог быть обнаружен при более низких или более высоких дозах химиотерапевтического препарата.
Анализ апоптоза как явления, потенциально вовлеченного в наблюдаемые эффекты на жизнеспособность клеток линии HepG2, не выявил каких-либо существенных различий в частоте апоптоза ни между обработанными образцами и их соответствующими контрольными группами, ни между ответами на различные виды терапии. Отсутствие проапоптотических эффектов согласуется с предыдущими результатами, в которых сообщалось, что CRET индуцирует цитостатические, а не цитотоксические эффекты в клетках линии HepG2 (26). Что касается сорафениба, то настоящие результаты также подтвердили предыдущие наблюдения об отсутствии у него проапоптотического воздействия на клетки линии HepG2 при назначении в концентрации 5 мкмоль (17). Потенциальные антипролиферативные эффекты CRET и сорафениба, применяемые вместе или по отдельности, оценивались путем количественного определения экспрессии PCNA и Ki67, двух специфических антигенов, связанных с пролиферацией, которые в настоящее время используются в качестве биомаркеров для клинического прогноза у пациентов с ГЦК (29,30). PCNA — это ядерный антиген, участвующий в репликации ДНК, молекулярном синтезе, восстановлении несоответствий и сборке хроматина (31). Ki67 — это ядерный белок, который присутствует только в пролиферирующих клетках (32). Во время интерфазы Ki67 участвует во внутриклеточном распределении антигенов гетерохроматина и ядрышковой ассоциации гетерохроматина. Во время митоза Ki67 вмешивается в формирование перихромосомного слоя, предотвращая таким образом митотическую агрегацию хромосом (33). Представленные результаты показали значительное снижение экспрессии обоих маркеров после 48 часов терапии с помощью только CRET-терапии, только сорафенибом или комбинированной терапией. Поскольку доклинические модели опухолей продемонстрировали, что подавление Ki67 или PCNA блокировало клеточный цикл и пролиферацию (32), эти результаты показали, что три применяемых метода лечения могут оказывать антипролиферативное действие на клетки линии HepG2. Кроме того, снижение экспрессии обоих белков, вызванное комбинированным лечением, было значительно сильнее, чем то, которое вызывалось посредством CRET-терапии при назначении по отдельности. Это может свидетельствовать о совместном или синергетическом действии антипролиферативных эффектов CRET-терапии и сорафениба при их одновременном применении. Потенциальные антипролиферативные эффекты также исследовались путем анализа процентного содержания клеток, присутствующих на различных фазах клеточного цикла. Полученные данные выявили небольшое, несущественное увеличение доли клеток в G0/G1-фазе после обработки только сорафенибом, что согласуется с ранее сообщенными результатами (34). В отсутствие сорафениба CRET-терапии индуцировала незначительное снижение процентного содержания клеток в S-фазе, что также согласуется с ранее представленными данными (1). Напротив, значительное снижение доли клеток в S-фазе наблюдалось в образцах, подвергнутых комбинированной обработке, что могло быть результатом усиливающего эффекта более слабых цитостатических ответов, потенциально индуцируемых каждым из обоих возбуждающих средств.
Клеточный цикл регулируется различными белками, включая циклин D1, который участвует в развитии клеточного цикла от G1-фазы к S-фазе. Этот циклин формирует активные комплексы с циклинзависимыми киназами CDK4 и CDK6, которые способствуют развитию клеточного цикла посредством фосфорилирования и инактивации белка ретинобластомы (35). Поскольку циклин D1 усиливается при гепатокарциномах (36), его ингибирование может быть полезной химиопрофилактической стратегией для лечения этого типа рака. Снижение экспрессии циклина D1, наведенное тремя обработками, оцененными в настоящем исследовании, согласуется с соответствующим снижением, наблюдаемым в количестве клеток в S-фазе. Взятые вместе, эти эффекты согласуются с вышеупомянутым антипролиферативным ответом. В соответствии с этими результатами предыдущее исследование показало, что CRET-терапия в сочетании с химическими препаратами может вызывать антипролиферативные эффекты, опосредованные остановкой клеточного цикла. Saitoh et al (15) сообщили, что CRET-терапия и аскорбиновая кислота синергически ингибируют пролиферацию опухолевых клеток асцита Эрлиха посредством образования активных форм кислорода и индуцирования остановки клеточного цикла в фазе G2/M. Была исследована возможность того, что сигнальный путь Ras/ERK1/2 может быть вовлечен в антипролиферативные ответы, наблюдаемые в настоящем исследовании. Сигнальный каскад Ras/Raf/MEK/ERK является важным сигнальным путем MAPK. Различные стимулы, способные активировать рецепторы клеточной поверхности, в свою очередь, активируют этот каскад, приводя к экспрессии ряда генов, которые регулируют клеточную пролиферацию, дифференцировку и апоптоз. ERK регулирует развитие клеточного цикла от G1-фазы к S-фазе посредством активации циклина D1, и было показано, что фосфорилирование ERK активирует множество молекул-мишеней, вовлеченных в рак печени. Поскольку известно, что киназа Raf сигнального пути Ras/ERK также является молекулярной мишенью сорафениба (25), в настоящем исследовании изучалось участие сигнального пути Ras/ERK в эффектах CRET-терапии, сорафениба и вышеупомянутого комбинированного лечения, а также потенциальные взаимодействия между химическими веществами. и электрическое лечение по такому пути. С этой целью в настоящем исследовании проанализированы уровни экспрессии активных и неактивных форм ERK1/2 и РЭФР, который является одним из рецепторов, активирующих сигнальный путь Ras/ERK1/2 (35). Антипролиферативное и ангиогенное действие сорафениба на клетки ГЦК опосредовано ингибированием путей Raf, BRAF, VEGFR2, VEGFR3 и PDGFR. Хотя путь РЭФР не был бы непосредственно вовлечен в эти эффекты, было показано, что активация этого рецептора модулирует чувствительность клеток к сорафенибу (36). Результаты, полученные в настоящем исследовании после 4 часов воздействия CRET-терапии, отдельно или в комбинации с сорафенибом, показали, что соотношения p ERK1/2/общий белок и p-РЭФР/общий белок снижались, что указывало на то, что эти методы лечения индуцируют значительное снижение активации, но не экспрессии, из ERK1/2 и РЭФР. Эти ранние эффекты, которые могли бы привести к замедлению кинетики сигнального пути MAPK/ERK (25), привели бы к антипролиферативным ответам, наблюдаемым 44 часа спустя. Кроме того, снижение активации РЭФР, индуцированное сорафенибом или в комбинации с ним, может способствовать снижению резистентности клеток линии HepG2 к сорафенибу.
В заключение, при концентрациях, оцененных в настоящем исследовании, не было обнаружено свидетельства того, что воздействие CRET-терапии может поставить под угрозу антипролиферативную эффективность сорафениба в отношении клеток линии HepG2. Кроме того, при стандартной фармакологической концентрации 5 мкмоль одновременная CRET-терапия индуцировала антипролиферативный ответ в клетках линии HepG2, который был значительно выше, чем тот, который индуцировался каждым из методов терапии при применении по отдельности. Такое увеличение может быть связано с замедлением клеточного цикла, опосредованным, по меньшей мере частично, снижением экспрессии циклина D1, и замедлением кинетики сигнального пути Ras/ERK1/2. Взятые вместе, эти данные не подтверждают гипотезу о том, что воздействие CRET-терапии может подавлять или уменьшать действие химиотерапевтического препарата, используемого для лечения рака. Несмотря на продемонстрированные положительные эффекты сорафениба в качестве средства лечения ГЦК, у значительного числа пациентов наблюдаются рецидивы (25,37,38). Настоящие результаты и наши ранее опубликованные данные об антипролиферативном ответе раковых клеток человека на субтермальную электрическую стимуляцию, применяемую отдельно или в комбинации с химическими агентами, согласуются с результатами ряда экспериментальных исследований по терапевтическому применению в онкологии (39-41). Таким образом, инновационные методы лечения, такие как CRET-терапии плюс химиотерапия, могут предложить новые возможности для улучшения выживаемости пациентов с раком и подчеркнуть необходимость дальнейших исследований новых терапевтических подходов к лечению рака, таких как основанные на комбинированном действии электрического и химического лечения.
Благодарности
Неприменимо
Финансирование
Настоящее исследование было проведено при финансовой поддержке Фонда биомедицинских исследований Университетской больницы Рамона-и-Кахаля (проект FiBio HRC; грант № 2015/0050) и Европейского Оборонного агентства/Министерства Обороны Испании (проект RF Biological Effects; грант № MOU EUROPA ERG 101.013).
Доступность данных и материалов
Наборы данных, использованные и/или проанализированные в текущем исследовании, доступны у соответствующего автора по обоснованному запросу.
Вклады авторов
MLHB, MAM, MAT и AU задумали и спланировали эксперименты, проанализировали и интерпретировали данные и написали рукопись. MLHB, MAM, MAT, LM и ETM провели эксперименты, а также собрали и проанализировали данные. MLHB, MAM и AU подтверждают подлинность всех исходных данных. Все авторы прочитали и одобрили окончательный вариант рукописи.
Одобрение по вопросам этики и согласие на участие
Неприменимо
Согласие пациента на публикацию
Неприменимо
Конфликт интересов
Авторы заявляют, что у них нет конфликта интересов.
Литература
1. Hernández‑Bule ML, Trillo MA, Cid MA, Leal J and Ubeda A: In vitro exposure to 0.57‑MHz electric currents exerts cytostatic effects in HepG2 human hepatocarcinoma cells. Int J Oncol 30: 583‑592, 2007.
2. Naranjo P, Lopez‑Estebaranz J, Shoaib T and Pinto H: Non‑ablative capacitive resistive 448 kHz radiofrequency for wrinkle reduction pilot study. Aesthetic Med 6: 41‑48, 2020.
3. Yokota Y, Tashiro Y and Suzuki Y: Effect of capacitive and resistive electric transfer on tissue temperature, muscle flexibility, and blood circulation. J Nov Physiother 7: 325‑331, 2017.
4. Coccetta CA, Sale P, Ferrara PE, Specchia A, Maccauro G, Ferriero G and Ronconi G: Effects of capacitive and resistive electric transfer therapy in patients with knee osteoarthritis: A randomized controlled trial. Int J Rehabil Res 42: 106‑111, 2019.
5. Pavone C, Romeo S, D'Amato F, Usala M, Letizia Mauro G and Caruana G: Does transfer capacitive resistive energy has a therapeutic effect on Peyronie's disease? Randomized, single‑blind, sham‑controlled study on 96 patients: Fast Pain Relief. Urol Int 99: 77‑83, 2017.
6. Bito T, Tashiro Y, Suzuki Y, Kajiwara Y, Zeidan H, Kawagoe M, Sonoda T, Nakayama Y, Yokota Y, Shimoura K, et al: Acute effects of capacitive and resistive electric transfer (CRet) on the Achilles tendon. Electromagn Biol Med 38: 48‑54, 2019.
7. Fousekis K, Chrysanthopoulos G, Tsekoura M, Mandalidis D, Mylonas K, Angelopoulos P, Koumoundourou D, Billis V and Tsepis E: Posterior thigh thermal skin adaptations to radiofrequency treatment at 448 kHz applied with or without Indiba® fascia treatment tools. J Phys Ther Sci 32: 292‑296, 2020.
8. Hernández‑Bule ML, Paíno CL, Trillo MÁ and Úbeda A: Electric stimulation at 448 kHz promotes proliferation of human mesenchymal stem cells. Cell Physiol Biochem 34: 1741‑1755, 2014.
9. Hernandez Bule ML, Angeles Trillo M, Martinez Garcia MA, Abilahoud C and Ubeda A: Chondrogenic differentiation of adipose‑derived stem cells by radiofrequency Electric stimulation. J Stem Cell Res Ther 7: 7, 2017.
10. Hernández‑Bule ML, Martínez‑Botas J, Trillo MÁ, Paíno CL and Úbeda A: Antiadipogenic effects of subthermal electric stimulation at 448 kHz on differentiating human mesenchymal stem cells. Mol Med Rep 13: 3895‑3903, 2016.
11. Hernández‑Bule ML, Medel E, Colastra C, Roldán R and Úbeda A: Response of neuroblastoma cells to RF currents as a function of the signal frequency. BMC Cancer 19: 889, 2019.
12. Trillo MÁ, Martínez MA and Úbeda A: Effects of the signal modulation on the response of human fibroblasts to in vitro stimulation with subthermal RF currents. Electromagn Biol Med 40: 201‑209, 2021.
13. Hernández‑Bule ML, Roldán E, Matilla J, Trillo MA and Ubeda A: Radiofrequency currents exert cytotoxic effects in NB69 human neuroblastoma cells but not in peripheral blood mononuclear cells. Int J Oncol 41: 1251‑1259, 2012.
14. Kato S, Saitoh Y and Miwa N: Repressive effects of a capacitive‑resistive electric transfer (CRet) hyperthermic apparatus combined with provitamin C on intracellular lipid‑droplets formation in adipocytes. Int J Hyperthermia 29: 30‑37, 2013.
15. Saitoh Y, Yoshimoto T, Kato S and Miwa N: Synergic carcinostatic effects of ascorbic acid and hyperthermia on Ehrlich ascites tumor cell. Exp Oncol 37: 94‑99, 2015.
16. Méndez‑Sánchez N, Vásquez‑Fernández F, Zamora‑Valdés D and Uribe M: Sorafenib, a systemic therapy for hepatocellular carcinoma. Ann Hepatol 7: 46‑51, 2008.
17. Liu L, Cao Y, Chen C, Zhang X, McNabola A, Wilkie D, Wilhelm S, Lynch M and Carter C: Sorafenib blocks the RAF/MEK/ERK pathway, inhibits tumor angiogenesis, and induces tumor cell apoptosis in hepatocellular carcinoma model PLC/PRF/5. Cancer Res 66: 11851‑11858, 2006.
18. Ge S and Huang D: Systemic therapies for hepatocellular carcinoma. Drug Discov Ther 9: 352‑362, 2015.
19. Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, de Oliveira AC, Santoro A, Raoul JL, Forner A, et al; SHARP Investigators Study Group: Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 359: 378‑390, 2008.
20. Wilhelm SM, Carter C, Tang L, Wilkie D, McNabola A, Rong H, Chen C, Zhang X, Vincent P, McHugh M, et al: BAY 43‑9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res 64: 7099‑7109, 2004.
21. Hernández‑Bule ML, Trillo MÁ and Úbeda A: Molecular mechanisms underlying antiproliferative and differentiating responses of hepatocarcinoma cells to subthermal electric stimulation. PLoS One 9: e84636, 2014.
22. Omar HA, Tolba MF, Hung JH and Al‑Tel TH: OSU‑2S/Sorafenib synergistic antitumor combination against hepatocellular carcinoma: The Role of PKCδ/p53. Front Pharmacol 7: 463, 2016.
23. Zhang SS, Ni YH, Zhao CR, Qiao Z, Yu HX, Wang LY, Sun JY, Du C, Zhang JH, Dong LY, et al: Capsaicin enhances the antitumor activity of sorafenib in hepatocellular carcinoma cells and mouse xenograft tumors through increased ERK signaling. Acta Pharmacol Sin 39: 438‑448, 2018.
24. Nowak E, Kammerer S and Küpper JH: ATP‑based cell viability assay is superior to trypan blue exclusion and XTT assay in measuring cytotoxicity of anticancer drugs Taxol and Imatinib, and proteasome inhibitor MG‑132 on human hepatoma cell line HepG2. Clin Hemorheol Microcirc 69: 327‑336, 2018.
25. Marisi G, Cucchetti A, Ulivi P, Canale M, Cabibbo G, Solaini L, Foschi FG, De Matteis S, Ercolani G, Valgiusti M, et al: Ten years of sorafenib in hepatocellular carcinoma: Are there any predictive and/or prognostic markers? World J Gastroenterol 24: 4152‑4163, 2018.
26. Hernández‑Bule ML, Cid MA, Trillo MA, Leal J and Ubeda A: Cytostatic response of HepG2 to 0.57 MHz electric currents mediated by changes in cell cycle control proteins. Int J Oncol 37: 1399‑1405, 2010.
27. Chai H, Luo AZ, Weerasinghe P and Brown RE: Sorafenib downregulates ERK/Akt and STAT3 survival pathways and induces apoptosis in a human neuroblastoma cell line. Int J Clin Exp Pathol 3: 408‑415, 2010.
28. Yang Y, Qin S‑K, Wu Q, Wang ZS, Zheng RS, Tong XH, Liu H, Tao L and He XD: Connexin‑dependent gap junction enhancement is involved in the synergistic effect of sorafenib and all‑trans retinoic acid on HCC growth inhibition. Oncol Rep 31: 540‑550, 2014.
29. Tiniakos DG and Brunt EM: Proliferating cell nuclear antigen and Ki‑67 labeling in hepatocellular nodules: A comparative study. Liver 19: 58‑68, 1999.
30. Ma S, Yang J, Li J and Song J: The clinical utility of the proliferating cell nuclear antigen expression in patients with hepatocellular carcinoma. Tumour Biol 37: 7405‑7412, 2016.
31. Boehm EM, Gildenberg MS and Washington MT: The many roles of PCNA in eukaryotic DNA replication. Enzymes 39: 231‑254, 2016.
32. Burkhart RA, Ronnekleiv‑Kelly SM and Pawlik TM: Personalized therapy in hepatocellular carcinoma: Molecular markers of prognosis and therapeutic response. Surg Oncol 26: 138‑145, 2017.
33. Sun X and Kaufman PD: Ki‑67: More than a proliferation marker. Chromosoma 127: 175‑186, 2018.
34. Duval AP, Troquier L, de Souza Silva O, Demartines N and Dormond O: Diclofenac potentiates sorafenib‑based treatments of hepatocellular carcinoma by enhancing oxidative stress. Cancers (Basel) 11: 11, 2019.
35. Dhillon AS, Hagan S, Rath O and Kolch W: MAP kinase signalling pathways in cancer. Oncogene 26: 3279‑3290, 2007.
36. Ji L, Lin Z, Wan Z, Xia S, Jiang S, Cen D, Cai L, Xu J and Cai X: miR‑486‑3p mediates hepatocellular carcinoma sorafenib resistance by targeting FGFR4 and EGFR. Cell Death Dis 11: 250, 2020.
37. Lei X‑F, Ke Y, Bao T‑H, Tang HR, Wu XS, Shi ZT, Lin J, Zhang ZX, Gu H and Wang L: Effect and safety of sorafenib in patients with intermediate hepatocellular carcinoma who received transarterial chemoembolization: A retrospective comparative study. World J Clin Cases 6: 74‑83, 2018.
38. Falzone L, Salomone S and Libra M: Evolution of cancer pharmacological treatments at the turn of the third millennium. Front Pharmacol 9: 1300, 2018.
39. Giladi M, Weinberg U, Schneiderman RS, Porat Y, Munster M, Voloshin T, Blatt R, Cahal S, Itzhaki A, Onn A, et al: Alternating electric fields (tumor‑treating fields therapy) can improve chemotherapy treatment efficacy in non‑small cell lung cancer both in vitro and in vivo. Semin Oncol 41 (Suppl 6): S35‑S41, 2014.
40. Yang W‑H, Xie J, Lai Z‑Y, Yang MD, Zhang GH, Li Y, Mu JB and Xu J: Radiofrequency deep hyperthermia combined with chemotherapy in the treatment of advanced non‑small cell lung cancer. Chin Med J (Engl) 132: 922‑927, 2019.
41. Wust P, Stein U and Ghadjar P: Non‑thermal membrane effects of electromagnetic fields and therapeutic applications in oncology. Int J Hyperthermia 38: 715‑731, 2021.
This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) License.

